Los receptores acoplados a proteínas G (GPCRs) constituyen
una gran superfamilia de proteínas que actúan como transductores
de señales a través de la membrana celular: en el exterior
reciben un ligando (un fotón en el caso de las opsinas, e.g. rodopsina),
y en el interior celular activan proteínas G. Los GPCRs están
constituidos por una sola cadena proteica de entre 450 y 600 aminoácidos
en la que se pueden identificar siete regiones de marcada hidrofobicidad,
que se pensó correspondían con mucha probabilidad a siete
hélices alfa que atravesarían la membrana celular.

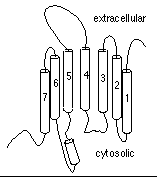
La resolución de la estructura de la rodopsina bacteriana (Halobacterium halobium) con la ayuda de técnicas de criomicroscopía electrónica (Henderson et al., J.Mol.Biol. 213, 899, 1990) y posteriormente difracción de rayos X de cristales crecidos en fases lipídicas cúbicas (Pebay-Peyroula et al. Science 277, 1676, 1997) permitió verificar esta hipótesis. La rodopsina bacteriana presenta 7 hélices alfa, que corresponderían a las regiones transmembrana (7TM), y seis asas de conexión entre ellas, tres de las cuales serían extracelulares y otras tres intracelulares. La región N-terminal está expuesta en la cara extracelular de la membrana mientras que la región C-terminal queda en el citoplasma.
La mayoría de los ligandos se unen entre las hélices, como por ejemplo el retinal , que forma una base de Schiff con el átomo Nz de la Lys 216 , aunque a veces las asas periplásmicas también están implicadas en el reconocimiento del ligando. Las asas citosólicas segunda y tercera, así como parte del extremo C-terminal (citosólico) del receptor, por el contrario, están implicados en el reconocimiento de la proteína G.
Aunque existen centenares de GPCRs, que pueden ser activados por multitud de agonistas, la activación de la proteína G conduce a la variación de niveles intracelulares de un número limitado de segundos mensajeros. En el proceso de activación de un GPCR se pueden distinguir 4 etapas:
En cada uno de los segmentos transmembrana (TM) de los GPCRs de la familia
A (relacionada con la rodopsina) se puede discerninr un patrón recurrente
del tipo:
TM1: GXXXN o GN
TM2: LXXXDXXXXXXXP o LXXXDXXXXXXXXP
TM3: SXXXLXXIXXDR o SXXXLXXI XXHR
TM4: WXXXXXXXXP o WXXXXXXXXXP
TM5: FXXPXXXXXXXY
TM6: FXXCXXP
TM7: LXXXXXXXDPXXY o LXXXXXXXNPXXY
Una vez establecidas las homologías entre los distintos receptores mediante
alineamiento de secuencias , al menos dentro de cada clase de la superfamilia de GPCRs, se pueden construir modelos tridimensionales de estos receptores mediante técnicas computacionales utilizando como plantillas las estructuras de la rodopsina bacteriana y la opsina bovina.
El modelo del receptor
beta-2 adrenérgico humano que se presenta aquí
fue generado en presencia del ligando endógeno (i.e. adrenalina)
unido, de modo que se corresponde con la forma R* (activa) del receptor
(Bywater et al. 'Using sequence information and model building to explore
subtype specificity in GPCRs', in "Protein Structure by Distance Analysis"
(Eds.: H. Bohr, S. Brunak), CRC Press, Boca Ratón FL, 1995). Al
igual que todos los otros miembros de la superfamilia GPCR, el receptor
beta2-adrenérgico se caracteriza por un plegamiento que consiste
en 7 hélices TM conectadas por 3 asas intracelulares y 3 asas extracelulares.
El receptor se orienta en la membrana de modo que el extremo N-terminal
es extracelular mientras que el extremo C-terminal se localiza en el citoplasma.
Al igual que sucede con muchos otros miembros de la superfamilia, este
extremo C-terminal queda anclado a la membrana plasmática por una
cadena de ácido graso que se une covalentemente a un residuo conservado
de cisteína.
Mediante experimentos de mutagénesis dirigida ha sido posible identificar muchos residuos clave implicados en estas etapas y en el proceso de activación constitutiva de muchos de estos receptores. Así, por ejemplo, la sustitución de la Tyr(364) por Phe en el extremo C-terminal del receptor beta-2 adrenérgico conduce a niveles basales de AMPc aumentados pero no afecta a la eficacia de la acumulación de AMPc producida por estimulación mediante agonistas (Karoor et al., "Phosphorylation of tyrosyl residues 350/354 of the beta-adrenergic receptor is obligatory for counterregulatory effects of insulin", J. Biol. Chem. 1995;270:25305-25308).